2024年10月8日,中国科学院上海药物研究所李亚平团队与上海交通大学王当歌团队联合在Advanced Functional Materials在线发表了题为Mobilizing STING pathway via a cationic liposome to enhance doxorubicin-induced antitumor immunity的研究论文。研究团队优选出一种阳离子脂质体,共递送STING激动剂cGAMP和阿霉素(DOX),通过激活STING通路增强DOX诱导的抗肿瘤免疫应答,改善癌症免疫治疗效果。

抗肿瘤蒽环类药物DOX通过激活癌细胞内源性I型干扰素(IFN-I)信号通路增强抗肿瘤免疫应答。然而,长期用药会导致IFN-I反应减弱,补充或增强IFN-I的分泌则可能恢复DOX的作用效果。STING通路激动剂cGAMP能够诱导IFN-I的释放,有望与DOX协同激活免疫应答,但是,药物在体内转运至肿瘤部位需要克服多重生理屏障,且cGAMP带有负电荷,难以跨越细胞膜进入胞内,因此cGAMP和DOX的协同高效递送仍面临挑战。
基于以上背景,研究团队构建了一系列含不同DOTAP比例的阳离子脂质体,在体外和体内水平从理化性质、细胞毒性、溶酶体逃逸能力和体内分布行为等方面进行了系统性评价,优选出兼具高肿瘤递送效率和强溶酶体逃逸能力的阳离子脂质体。实验结果表明,优选的载DOX和cGAMP脂质体(DGL)可以高效分布于肿瘤部位,诱导肿瘤免疫原性细胞死亡效应和STING通路激活,从而改善内源性IFN-I的产生,促进树突状细胞成熟并激活抗肿瘤T细胞免疫应答。此外,肿瘤微环境中调节性T细胞比例下降,IFN-γ+CD8+ T细胞比例提高,有利于解除肿瘤微环境的免疫抑制,有效抑制了B16-F10黑色素瘤的生长。本研究发现了一种通过激活STING通路恢复IFN-I水平来增强DOX诱导免疫应答的新策略,并提供了实现蒽环类化疗药-STING激动剂高效协同递送的新载体。
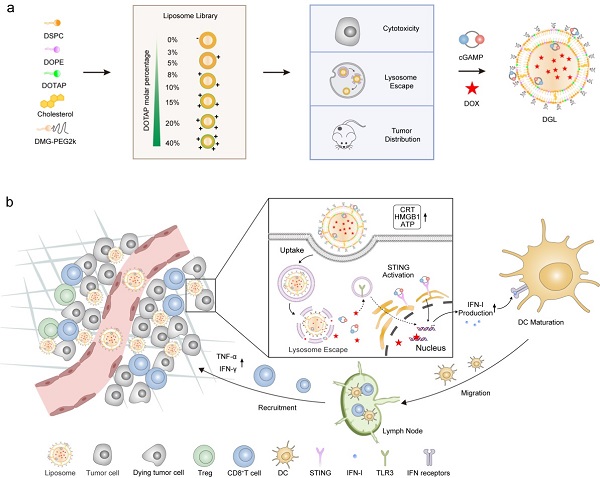
阳离子脂质体DGL的构建及其抗肿瘤作用机制
上海药物所李亚平研究员、上海交通大学王当歌研究员为本文共同通讯作者。上海药物所博士研究生刘晓琛、赵质文为论文共同第一作者。该研究得到了科技部重点研发计划、国家自然科学基金和上海市科委等项目的资助。中国科学院上海高等研究院国家蛋白质科学研究(上海)设施对实验予以支持。
全文链接:https://doi.org/10.1002/adfm.202416406
(供稿部门:药物制剂研究中心;供稿人:尹琦)

