近日,中国科学院上海药物研究所黄河课题组与芝加哥大学赵英明教授团队合作,鉴定了乳酰CoA合成酶GTPSCS,并揭示了GTPSCS/p300/H3K18la信号轴协同调控组蛋白H3K18la水平和GDF15表达,促进胶质瘤细胞增殖和放射耐药的表观遗传新机制。该成果于2024年12月5日以“Nuclear GTPSCS functions as a lactyl-CoA synthetase to promote histone lactylation and gliomagenesis”为题发表在Cell Metabolism杂志上。
乳酸 (Lactate) 是哺乳动物糖酵解代谢中的主要产物,其生物学功能因肿瘤细胞中存在的“瓦伯格效应(Warburg effect)”而得到广泛关注。组蛋白赖氨酸乳酰化修饰(Lysine lactylation)通路是一种生理和病理相关的表观遗传途径,可以被Warburg效应产生的乳酸诱导增强。然而,细胞利用乳酸生成乳酰辅酶A (Lactyl-CoA)的具体机制以及这一过程如何被调节仍然未知。
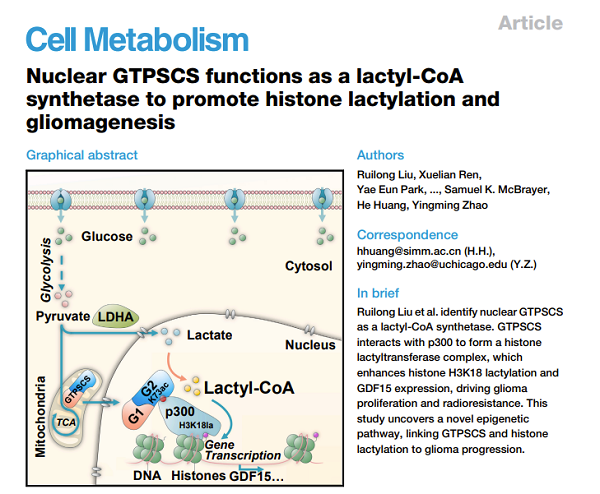
本项研究中,科研人员首先通过在细胞水平上筛选12个脂肪酰基辅酶A合成酶,发现琥珀酰辅酶A合成酶GTPSCS能够显著调节组蛋白Kla水平,并与胶质瘤的分级和预后相关。GTPSCS通常被认为是一种线粒体合成代谢酶,在肝脏的合成代谢过程中发挥作用。鉴于GTPSCS对组蛋白Kla的影响,作者推测GTPSCS可能具有乳酰辅酶A合成酶活性。为证实这一推测,首先开展了体外酶活实验进行验证,结果表明GTPSCS可催化乳酸形成乳酰辅酶A,其米氏常数(Km)为15.32 ± 1.28 mM。其次,晶体衍射结果显示GTPSCS主要通过N308位置氢键与乳酸相互作用结合(图1)。
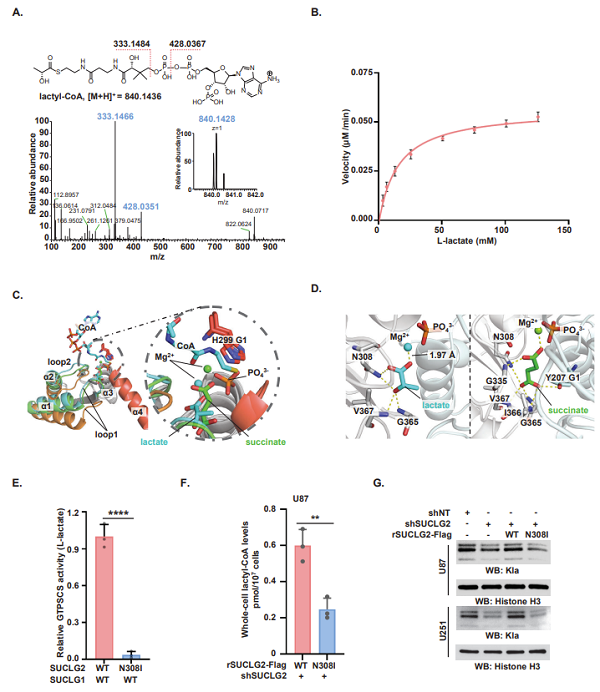
图1. GTPSCS是乙酰辅酶A合成酶
乳酸和乳酰辅酶A是调节组蛋白乳酰化修饰的关键前体。研究表明乳酸主要在胞浆中通过糖酵解产生,然而,组蛋白乳酰化修饰却发生在细胞核中,细胞核内的乳酰辅酶A是在胞质中生成后再进行核易位,还是在细胞核中重新合成尚不清楚。作者通过免疫荧光染色发现GTPSCS能进行核易位,且依赖于G1亚基的核定位序列。为了进一步揭示GTPSCS介导组蛋白乳酰化修饰的机制,作者通过亲和纯化质谱以及体外免疫共沉淀等实验验证GTPSCS的G2亚基残基K73的乙酰化介导其与p300的相互作用(图2)。为了确定p300/ GTPSCS调控的组蛋白Kla修饰位点,作者通过基于SILAC的定量蛋白质组学发现H3K18la是核GTPSCS/p300复合体调节的主要组蛋白Kla位点,且不调控H3K18succ的水平。以上数据表明,GTPSCS核定位以及K73ac修饰是形成活跃的GTPSCS/p300核复合物以进行组蛋白乳酰化反应所必需的。
图2. GTPSCS在体内与p300相互发挥乳酰辅酶A合成酶的功能
乳酸脱氢酶依赖的乳酸合成已被证明通过多种机制促进胶质瘤的进展。此外,血清中乳酸水平与胶质瘤分级密切相关。由于GTPSCS催化乳酸形成乳酰辅酶A进而调控Kla水平,作者进一步探索了GTPSCS介导的Kla在胶质瘤细胞中的生物学功能。通过ChIP-Seq和RNA-Seq分析发现,H3K18la在GDF15、SCX和DYNLT4等基因的启动子区域高度富集。此前研究表明GDF15与胶质母细胞瘤(GBM)预后不良和免疫逃逸有关,研究者通过TCGA数据库验证发现GDF15与SCX基因的高表达与GBM患者预后不良有关,而GTPSCS亚基的基因突变降低了GDF15的表达。以上结果表明GDF15是GTPSCS/p300/H3K18la轴的重要靶点,在胶质瘤的进展中发挥重要作用。
为了探讨GTPSCS对胶质瘤形成的影响,研究者进行裸鼠皮下异种移植实验,结果表明G1亚基的核定位信号和G2亚基的K73ac是GTPSCS调节组蛋白Kla水平,促进胶质瘤细胞增殖和肿瘤发展的关键。其次,研究者通过检测170例胶质瘤临床组织中H3K18la与核内GTPSCS的水平,发现两者表达呈正相关。该研究表明GTPSCS作为乳酰辅酶A合成酶易位进入细胞核并与p300相互作用调控组蛋白乳酰化,这一过程依赖于GTPSCS G1亚基的核定位信号和G2亚基K73的乙酰化,GTPSCS/p300协同调节组蛋白H3K18la和GDF15的表达,促进胶质瘤进展(图3)。
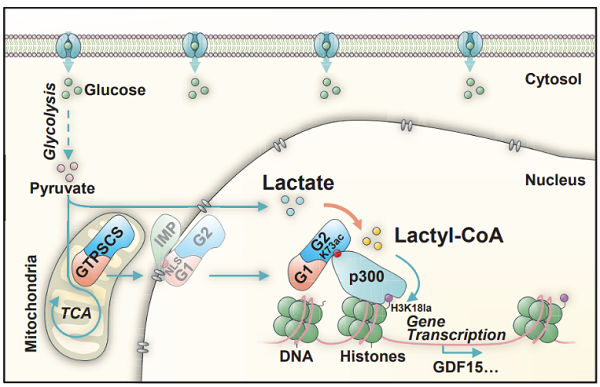
图3. GTPSCS通过组蛋白H3K18la促进胶质瘤进展的模型示意图
该研究发现GTPSCS是乳酰辅酶A合成酶,揭示GTPSCS在胶质瘤中通过催化乳酰辅酶A合成调控组蛋白乳酰化的表观遗传和致癌基因表达,阐明了GTPSCS利用肿瘤产生的高乳酸,操纵其代谢途径以支持肿瘤增殖的特定机制。这种复杂的相互作用表明GTPSCS在协调癌症相关代谢改变中的重要性,揭示了旨在破坏维持胶质瘤生长的代谢适应性的治疗干预潜在靶点。
上海药物所/芝加哥大学博士后刘瑞隆为该论文的第一作者,芝加哥大学赵英明教授和上海药物所黄河研究员为本文的共同通讯作者,上海药物所为该论文的第一完成单位。本研究得到国家自然科学基金委、上海市科技重大专项等基金资助。
全文链接:https://www.cell.com/cell-metabolism/fulltext/S1550-4131(24)00451-0
(供稿部门:黄河课题组;供稿人员:严聪)

