中国科学院上海营养与健康研究所李于研究组发现丝氨酸/苏氨酸蛋白磷酸酶PPP6C在小鼠和人类代谢功能障碍相关脂肪性肝炎(MASH)中具有重要调节作用。该研究首次揭示,肝细胞中的PPP6C通过响应成纤维细胞生长因子21(FGF21)/βKlotho信号通路,显著改善纤维化与MASH的疾病进程。这一发现为深入探索FGF21在临床治疗MASH中的分子机制,以及FGF21激动剂作为新兴疗法的潜力,提供了坚实的理论依据和研究基础。2月10日,相关研究成果在线发表于肝病学领域权威期刊Journal of Hepatology。
代谢功能障碍相关脂肪肝炎目前已成为全球最常见的慢性肝脏疾病,显著增加肝硬化和肝细胞癌的发病风险。FGF21激动剂在治疗MASH方面的潜力巨大,随着临床研究的深入,其有望成为治疗代谢功能障碍相关脂肪肝炎的首选药物。尽管FGF21类似物在多项临床试验中表现出良好的耐受性和显著疗效,但FGF21改善和治疗MASH分子机制仍不明确。
为阐明FGF21是否通过自分泌的方式调控MASH进展,研究团队首先构建了FGF21的辅受体βKlotho肝细胞特异性敲除小鼠模型。通过构建饮食诱导MASH模型,并结合FGF21重组蛋白与FGF21类似物B1344皮下注射干预,研究发现肝细胞βKlotho敲除显著阻断FGF21对MASH的改善作用,证实FGF21通过肝细胞表面FGFR/βKlotho受体复合物介导的自分泌信号通路改善MASH进程。
为深入解析FGF21调控MASH的分子机制,研究人员采用蛋白质相互作用质谱筛选技术,首次鉴定出蛋白磷酸酶PPP6C能够直接与βKlotho结合,并能响应FGF21信号。研究发现肝细胞PPP6C缺失不仅显著加剧MASH进展,而且阻断了FGF21对MASH的治疗效果,提示PPP6C在FGF21信号通路中发挥重要作用。
在分子机制层面,FGF21/βKlotho信号通路通过激活PPP6C磷酸酶活性,促进其与结节性硬化复合物2(TSC2)形成复合物,进而抑制TSC2在Ser939/Thr1462位点的磷酸化,最终下调mTORC1信号通路活性。这一调控过程促使转录因子TFE3和Lipin1发生核转位,最终实现抑制脂质合成相关基因表达、促进脂肪酸氧化基因转录的双重调控。
值得注意的是,在临床患者和小鼠MASH肝脏组织中PPP6C表达水平显著下降,表明PPP6C及其介导的TSC2去磷酸化修饰可能在小鼠及人的MASH发病过程中均发挥重要作用。
本研究发现FGF21通过肝细胞FGFR/βKlotho介导的自分泌信号通路显著增强PPP6C活性。FGF21的药理学作用主要通过βKlotho与PPP6C的直接相互作用,以及PPP6C介导的肝细胞TSC2去磷酸化来有效抑制MASH病理进展。这一重要发现提示,通过靶向PPP6C活性,可能为肝纤维化和MASH的治疗提供新的策略和潜在治疗靶点。
中国科学院上海营养与健康研究所李于研究员为本论文通讯作者,博士研究生刘正帅、魏双与博士后蒋洋为本论文共同第一作者。该研究得到香港大学徐爱民教授、美国得克萨斯大学圣安东尼奥健康科学中心臧梦维教授、天士力医药集团股份有限公司李剑博士、国科大杭州高等研究院林旭教授、西南医科大学附属医院徐勇教授、付文广教授等的支持和帮助。该研究得到国家自然科学基金委、国家科技部重点研发计划、上海市市级重大专项、代谢性血管疾病四川省重点实验室开放课题的资助,同时得到中国科学院上海营养与健康研究所所级公共技术中心的支持。
研究论文链接:https://www.journal-of-hepatology.eu/article/S0168-8278(25)00079-0/fulltext
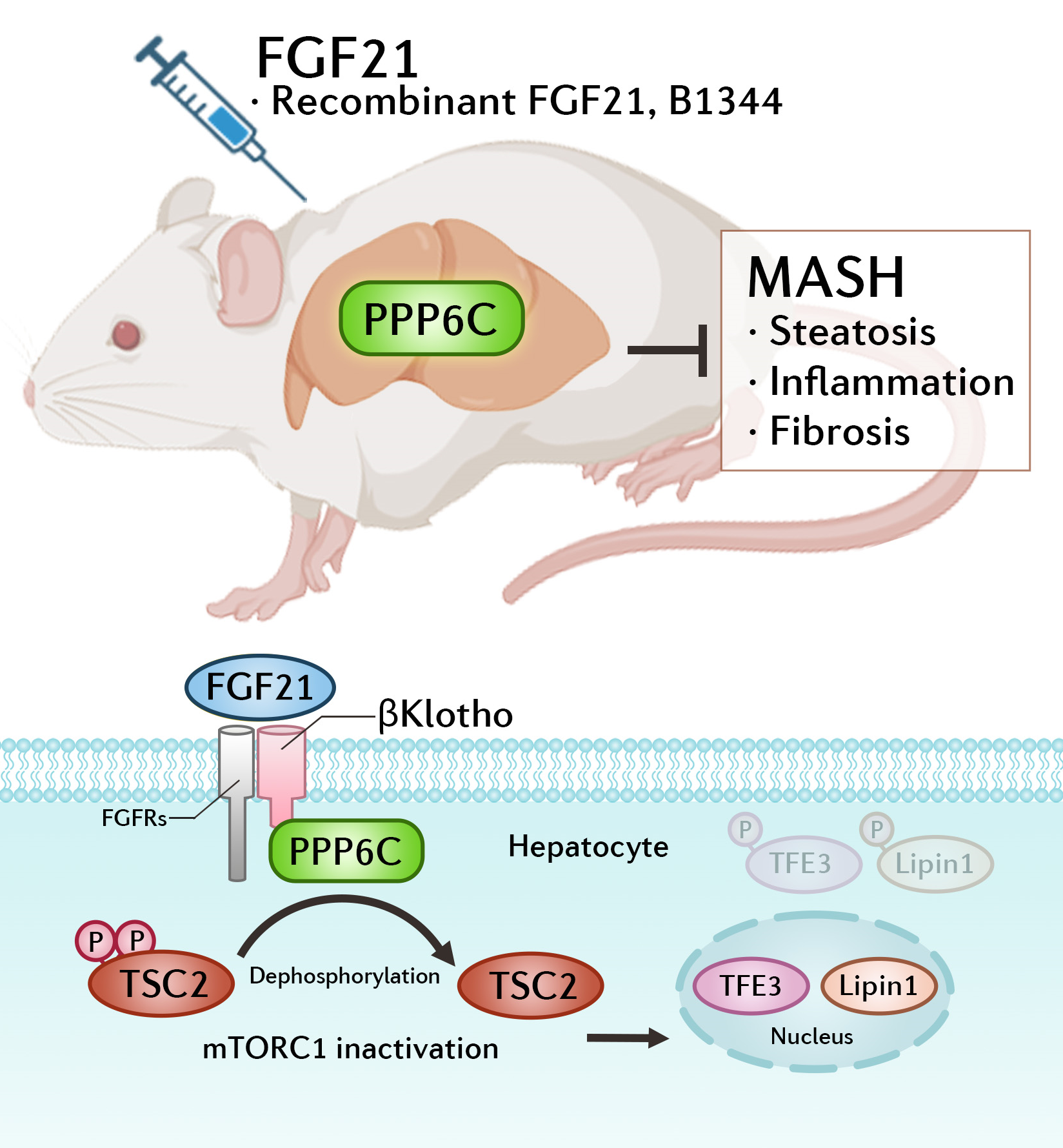
FGF21激活PPP6C治疗肝纤维化与代谢功能障碍相关脂肪性肝炎
FGF21通过肝细胞βKlotho-PPP6C相互作用,以自分泌方式改善MASH。具体而言,FGF21/βKlotho激活PPP6C磷酸酶活性,招募并介导TSC2在Ser939/Thr1462位点的去磷酸化,抑制mTORC1活性并促进转录因子TFE3/Lipin1核转位。该发现为FGF21激动剂作为新兴的治疗方案奠定了重要理论基础,通过靶向调控PPP6C活性可能为MASH的临床治疗提供新策略。

