随着耐药性问题日益加剧,新型先导化合物的需求持续增长。DNA作为关键药物靶点,其靶向化合物在抗菌、抗疟和抗癌等领域具有广泛应用。能够与DNA发生共价结合的DNA烷基化天然产物,因其独特的作用机制展现出显著的生物活性,在抗癌和抗菌方面展现出巨大潜力。当前已知的此类天然产物数量有限,仍需持续深入挖掘以拓展其结构与功能多样性,并为新型先导药物的开发提供分子基础。由于DNA烷基化天然产物对宿主自身具有较强毒性,相关微生物通常依靠独特的自抗性机制来避免产生化合物时对自身可能带来的伤害。研究表明,HEAT-like repeat或HTH-42超家族DNA糖苷酶成员可通过碱基切除修复(BER)通路清除DNA中被烷基化的碱基加合物,从而降低化合物对宿主的毒性。中国科学院上海有机化学研究所唐功利课题组长期致力于抗生素自抗性机制研究,已在萘啶霉素、CC1065、三欣卡辛和LL-D49194等经典DNA烷基化天然产物的生物合成和自抗性机制方面取得系列进展。
近日,该课题组在《德国应用化学》(Angewandte Chemie International Edition)发表了题为“Targeted Discovery and Characterization of Type-II PKS-NRPS Hybrid DNA-Alkylating Antibiotics”的研究论文(DOI: 10.1002/anie.202512820)。在该研究中,团队以HTH-42超家族自抗性基因为探针,定向挖掘出一个沉默生物合成基因簇xhn。通过激活该基因簇,研究者们从星海链霉菌(Streptomyces xinghaiensis)中分离并鉴定出一类结构独特的DNA烷基化天然产物——星海卡辛(xinghaicarcins)。该类化合物具有一个复杂的环氧螺环螺缩酮七环骨架,并携带一个甲基哌啶酸边链(图1),显示出其在结构上的独特性。
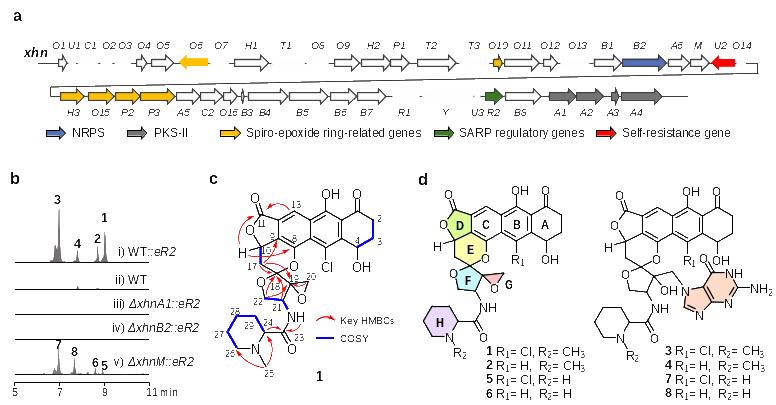
图1. 星海卡辛的发现和鉴定
在对星海卡辛类化合物的生物合成机制研究中,研究人员发现该类化合物由II型聚酮合酶-非核糖体肽合成酶(PKS-II-NRPS)杂合体系协同组装而成。转氨还原双功能酶 XhnB1、NRPS模块蛋白 XhnB2 以及KSIII型酶 XhnA6 共同参与L-哌啶酸结构单元的生物合成与上载,从而构建聚酮–非核糖体肽类核心骨架。后续由甲基转移酶 XhnM 催化完成N-甲基哌啶酸单元的形成。随后,研究人员通过解析XhnM与星海卡辛-碱基加合物的共晶结构,明确了星海卡辛中六个手性中心的立体构型,为其立体化学确证提供了坚实依据,并为不稳定天然产物的立体化学解析提供了新思路。
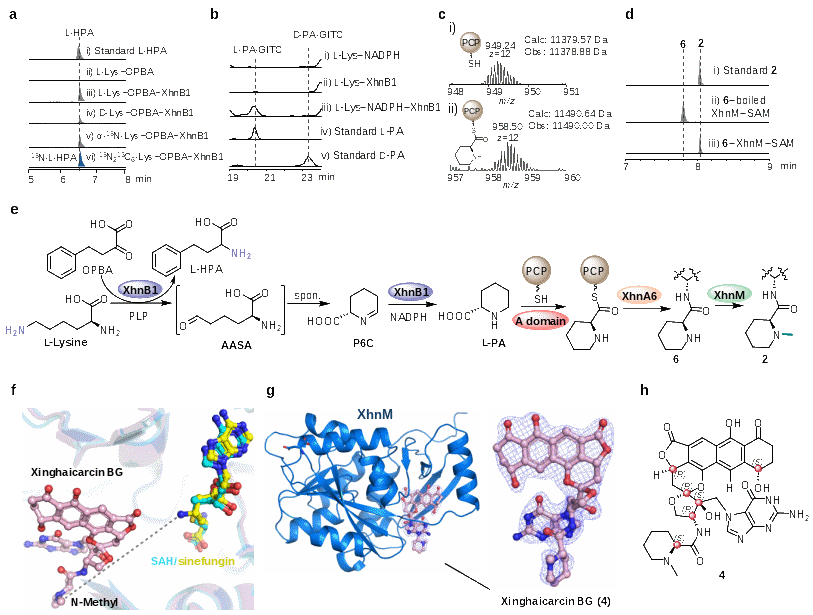
图2. 星海卡辛的生合成研究及立体构型解析
含有环氧结构的星海卡辛对多重耐药菌株,包括金黄色葡萄球菌MRSA和表皮葡萄球菌MRSE,展现出显著的抗菌活性。它们对多种癌细胞系亦表现出强效的细胞毒性。此外,研究者们进一步揭示了星海卡辛的DNA烷基化机制:星海卡辛的环氧结构可被鸟嘌呤进攻从而形成DNA-星海卡辛的复合物。最后,研究者们还发现HTH-42超家族蛋白XhnU2能够解离DNA-化合物加合物,从而缓解星海卡辛的毒性,进一步明确了其自抗性机制。
本研究系统性地完成了星海卡辛的发现、结构解析、生物合成、生物活性、作用机制及自抗性机制的研究(图3),拓展了DNA烷基化天然产物的结构多样性,并为进一步发现更多高活性、新结构的天然产物奠定了基础。
中国科学院上海有机化学研究所唐功利研究员为通讯作者,聂秋玥博士、博士研究生方诗绮以及吴联副研究员为论文的共同第一作者。上述研究工作得到了上海市科技重大专项,国家自然科学基金和生命过程小分子调控全国重点实验室的资助。

